肝细胞癌(HCC)是全球范围内导致癌症相关死亡的主要原因之一,尤其在亚洲地区,其发病率和死亡率居高不下。尽管近年来免疫检查点抑制剂(ICI)在HCC的治疗中取得了显著进展,但并非所有组合都能显著提高总体生存率,这凸显了寻找新型有效药物的必要性。安罗替尼是一种多激酶抑制剂,已在中国被批准作为HCC三线治疗的标准用药。安罗替尼通过抑制多种激酶(包括VEGFR、FGFR、PDGFR和c-Kit等)来发挥抗肿瘤作用,具有广泛的抗血管生成和直接抗肿瘤效应。派安普利单抗是一种新型人源化IgG1抗体,具有高亲和力结合PD-1的能力,并且相较于目前批准的IgG4 PD-1抑制剂,具有更高的稳定性和更低的免疫相关不良事件风险。基于上述背景,本研究旨在评估安罗替尼联合派安普利单抗与索拉非尼在不可切除HCC患者中的一线治疗效果。通过这一研究,我们希望能够为这一患者群体提供一种新的、更有效的治疗选择。

方法
APOLLO试验是一项多中心、开放标签、平行对照、随机、III期临床试验,在中国79个中心进行。符合条件的患者年龄在18-75岁之间,诊断为不可切除HCC,既往未接受过系统性治疗,东部肿瘤协作组(ECOG)体能状态评分为0或1。患者按2:1的比例随机分配至安罗替尼(10 mg口服,每日一次,第1-14天)联合派安普利单抗(200 mg静脉注射,第1天)组或索拉非尼(400 mg口服,每日两次)组。随机化通过中心化的区组随机化系统进行,区组大小固定为3,并根据是否存在大血管侵犯或肝外转移、甲胎蛋白浓度和ECOG体能状态进行分层。主要研究终点是由独立评审委员会评估的无进展生存期(PFS)和意向治疗人群的总体生存期(OS)。安全性评估包括所有接受至少一剂研究药物并进行至少一次安全性评估的参与者。
研究结果
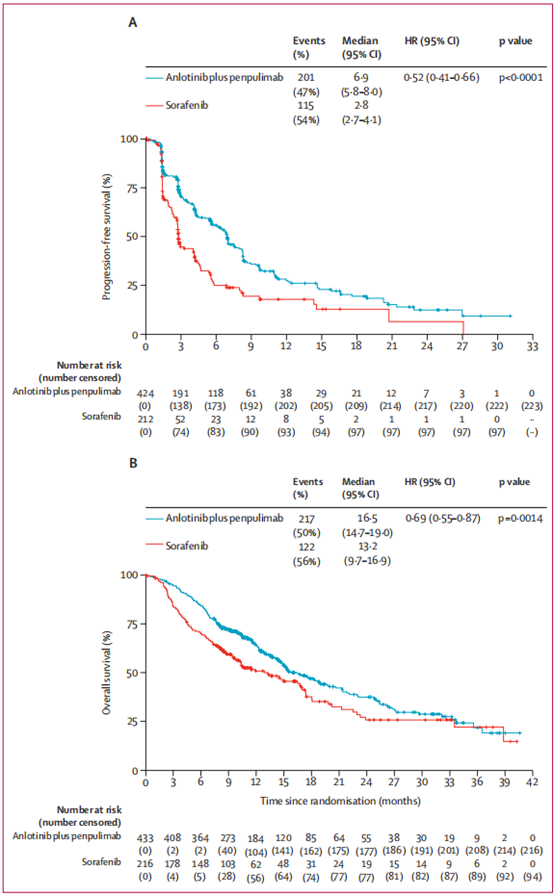
从2020年8月11日至2023年6月20日,共筛选了940名患者,最终649名患者被随机分配至安罗替尼联合派安普利单抗组(433名)或索拉非尼组(216名)。截至2023年6月5日的最终PFS分析,安罗替尼联合派安普利单抗组的中位随访时间为6.2个月,索拉非尼组为4.2个月。安罗替尼联合派安普利单抗组的中位PFS显著延长至6.9个月(95% CI 5.8-8.0),而索拉非尼组为2.8个月(2.7-4.1)(风险比[HR] 0.52,95% CI 0.41-0.66;P<0.0001)。截至2024年1月29日的第二次中期OS分析,安罗替尼联合派安普利单抗组的中位OS显著延长至16.5个月(95% CI 14.7-19.0),而索拉非尼组为13.2个月(9.7-16.9)(HR 0.69,95% CI 0.55-0.87;P=0.0014)。
安全性分析
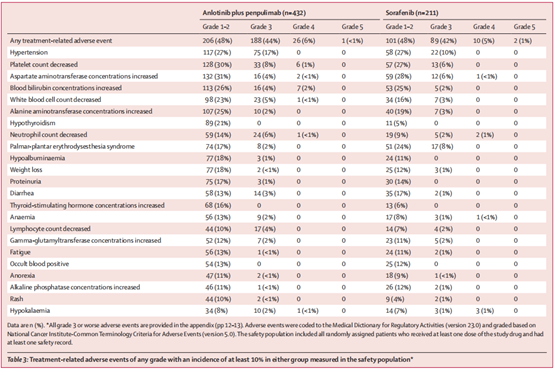
在安全性方面,安罗替尼联合派安普利单抗组和索拉非尼组分别有99%和99%的患者发生了至少一次治疗相关不良事件(TRAE)。两组中≥3级TRAE的发生率分别为50%和48%。因TRAE导致剂量减少的患者比例分别为20%和32%,因TRAE导致治疗中断的患者比例分别为46%和39%。治疗相关严重不良事件的发生率分别为21%和9%。治疗相关死亡的发生率分别为1%(上消化道出血)和1%(肝衰竭和未知原因)。
结论
APOLLO试验成功达到了其共同主要终点,显示安罗替尼联合派安普利单抗在不可切除HCC患者中显著延长了PFS和OS,相较于索拉非尼。该组合的安全性良好,免疫相关毒性较低,支持其作为不可切除HCC患者的一线治疗新选择。这些发现需要在世界其他地区进行验证。
原始出处
Zhou, J., Bai, L., Luo, J., Bai, Y., Pan, Y., Yang, X., Gao, Y., Shi, R., Zhang, W., Zheng, J., Hua, X., Xu, A., Hu, S., Zhang, F., Yang, X., Da, M., Wang, R., Ma, J., Jia, W., Quan, D., Peng, C., Yang, W., Yin, G., Qi, Y., Zhang, G., Du, X., Mao, X., Meng, Z., & APOLLO Study Group. (2025). Anlotinib plus penpulimab versus sorafenib in the first-line treatment of unresectable hepatocellular carcinoma (APOLLO): a randomised, controlled, phase 3 trial. The Lancet Oncology, 26(5), 1234-1245.




