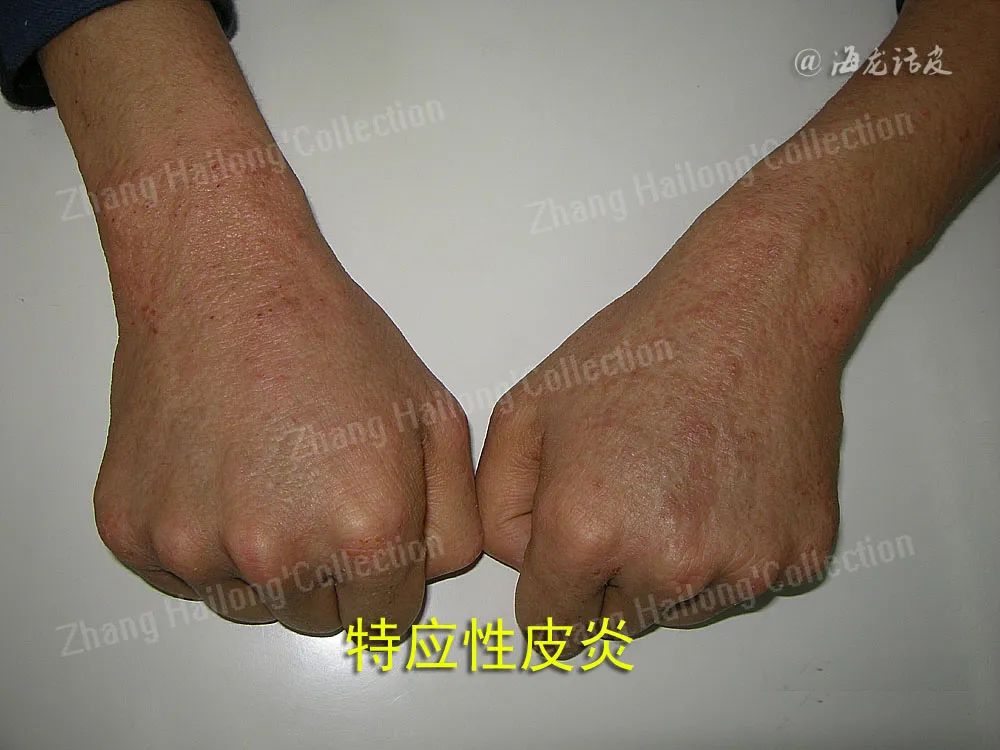
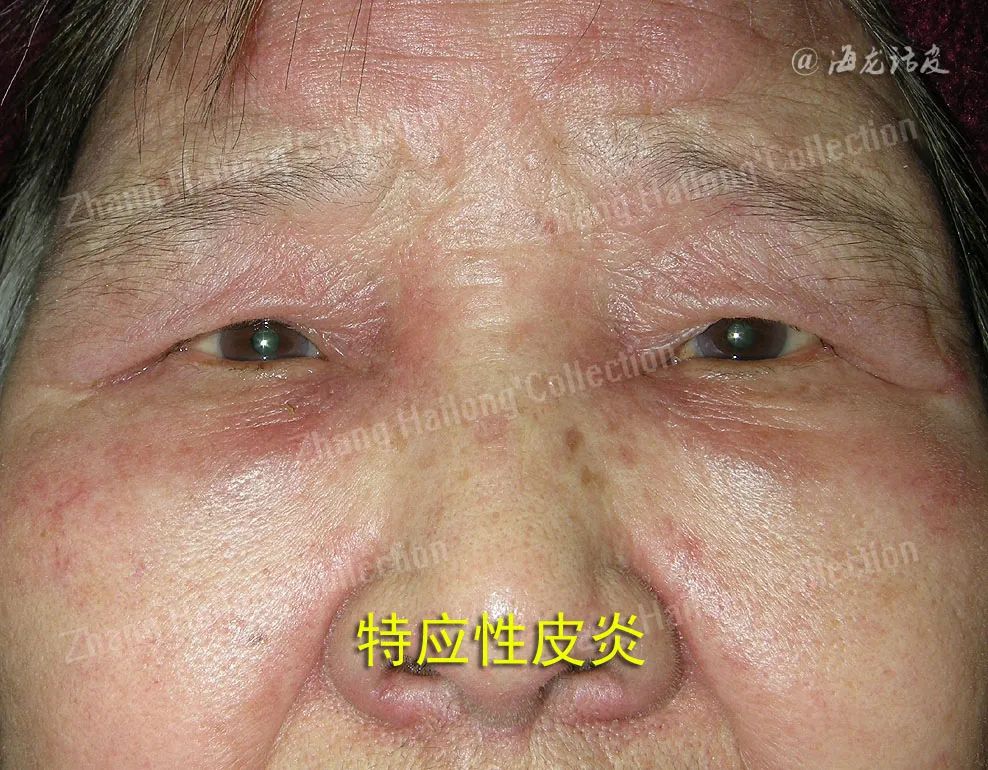
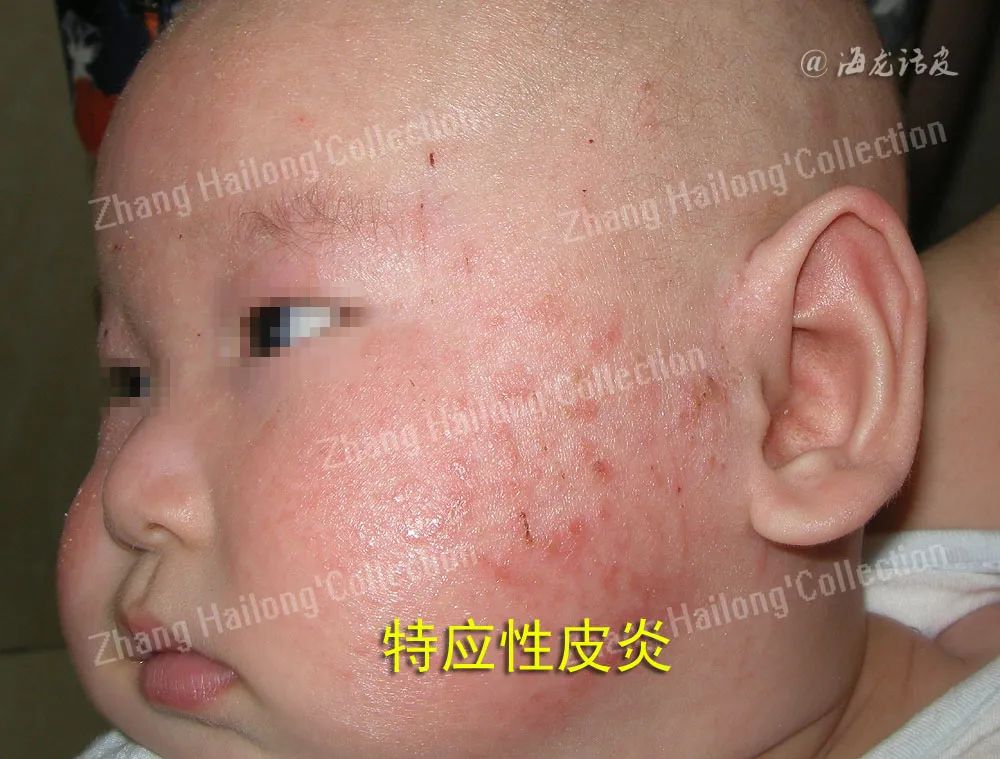
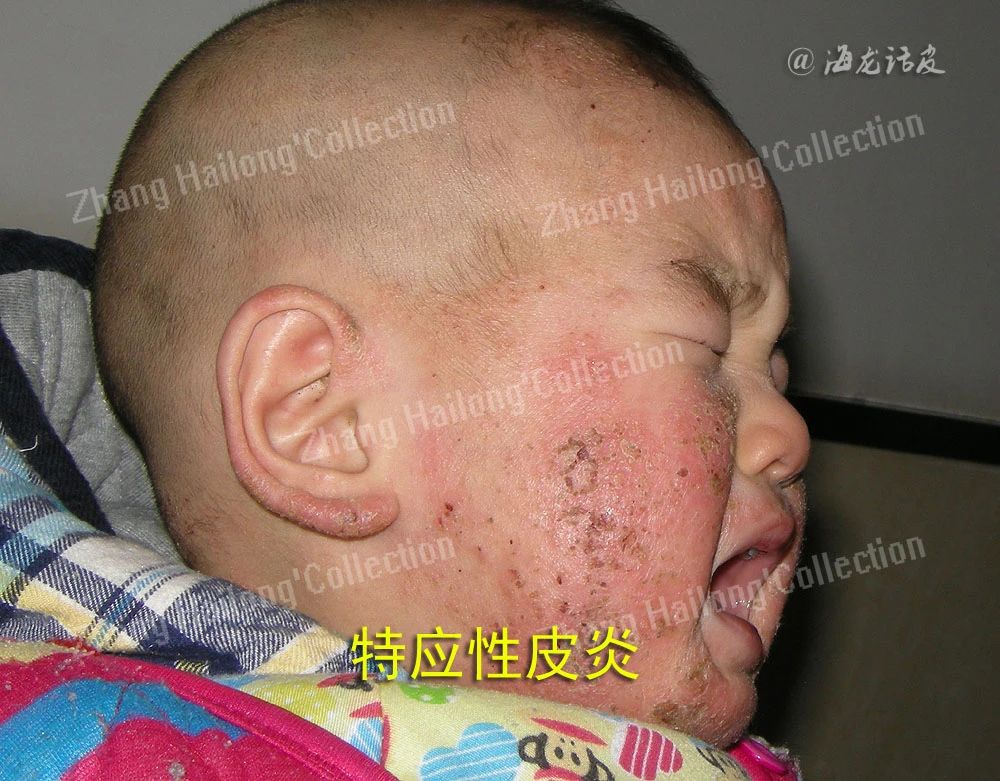
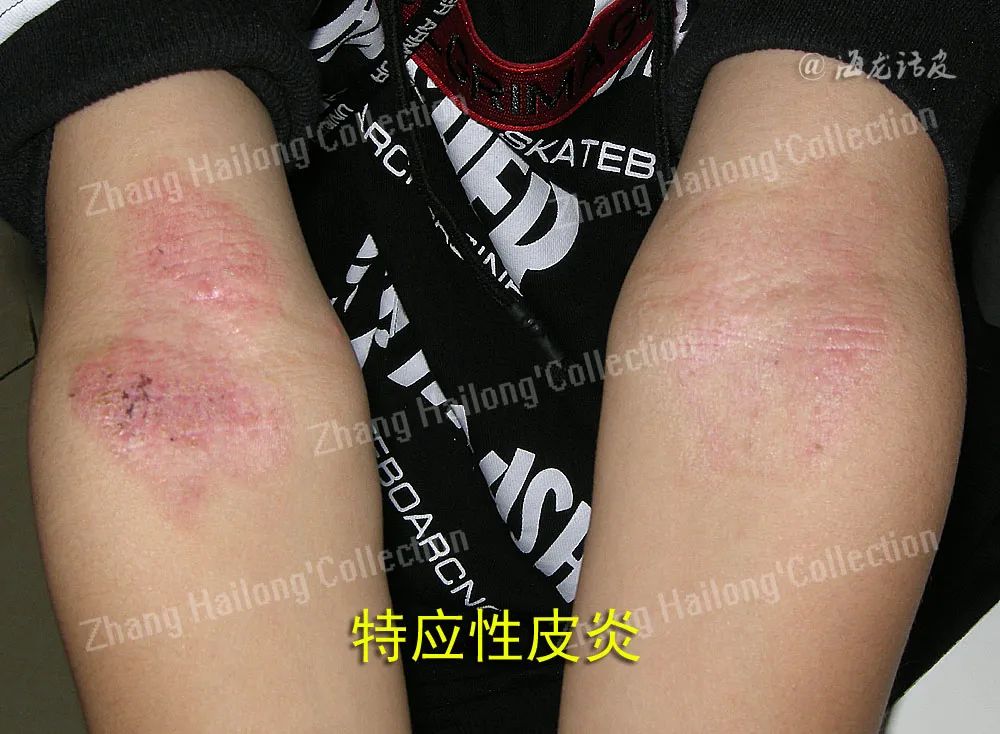
特应性皮炎(atopic dermatitis,AD)是一种慢性炎症性皮肤病,多从婴幼儿期开始起病,易反复发作,罹患终身。其临床表现多样,不同年龄阶段床特征不同,临床上多以瘙痒、干燥和湿疹样变为特征,对患者身心造成严重影响。在发达国家中儿童AD患病率可达20%,我国患病率也逐年上升。AD病因和发病机制复杂,目前多认为与遗传因素、环境因素、免疫功能失调、微生物定植及皮肤屏障障碍等相关。
1.内源性因素
1.1遗传因素
丝聚蛋白(filaggrin)与角蛋白中间丝形成聚集体参与角质形成细胞结构构成,另一方面丝聚蛋白和内批蛋白、包斑蛋白等相互交联形成表皮角化套膜(cornified envelopes,CE),与角质细胞、桥粒等成分共同构成表皮屏障结构。染色体lq21上编码丝聚蛋白前体FLG基因功能突变是AD发病的主要遗传危险因素。中重度儿童AD与FLG2的rs12730241和rs6587667突变有关,有FLG基因突变(R1798X、R501X、S126X和S761fs)的AD患者病情更严重。
编码胶原蛋白基因的多态性会影响细胞外基质功能,在AD患者中Col3A1/rs1800255的AA基因型通常病情较轻,瘙痒症状不明显,SCORAD评分低于GG、AG型。模式识别受体(PRR)信号通路TLR受体和IgE受体(FcεRI)相互作用可影响AD严重程度,TLR2 rs4696480纯合子突变且携带FCER1A rs2252226次要等位基因的患者SCORAD评分更高。TMEM232基因突变也与AD相关,TMEM232上的rs13361382和SCORAD评分存在显着关联信号,其机制尚不明确,认为TMEM232突变基因可能是AD人群的易感基因。
1.2年龄和早产
Cansever等研究发现中重度AD患者发病年龄低于轻度患者,表明年龄在对AD严重程度的影响中发挥作用。监测早期出现AD症状的患者并进行长程管理和随访对于降低AD严重程度具有必要性。早产与AD风险降低存在关联,与早产儿相比,足月儿童更早出现AD临床表现,发病时病情更重。其中的潜在机制尚未明确,有研究认为早产儿FLG突变发生率较低,降低了AD发生风险。
1.3个人及家族过敏史
多项研究发现中重度AD、早发型和持续性AD患哮喘和过敏性鼻炎的概率增加,空气过敏原可诱导伴过敏性鼻炎的早发型儿童AD病情加重。AD和哮喘、过敏性鼻炎具有共同遗传起源,会出现共同风险变异调节免疫相关基因表达来发挥作用。外界吸入过敏原通过受损的表皮屏障进入皮肤,产生Th2细胞并迁移到呼吸道黏膜,导致气道反应性升高,诱导全身性IL-4、IL-5和IL-13水平升高,从而导致AD、哮喘、过敏性鼻炎等疾病共同发生。
特应性家族史是AD的独立危险因素,合并家族过敏史的婴幼儿是AD发病的高危人群,成人患病率也明显升高,有研究认为家族过敏史对预测AD严重程度具有重要作用,合并家族性过敏史的AD患者多为中重度。也有研究认为过敏性家族史对任何年龄段的AD都会产生影响,与疾病严重程度无关。
1.4精神因素
中、重度AD患者通常伴有焦虑、抑郁,疾病严重程度是导致AD患者焦虑和抑郁发展的主要驱动因素。有研究观察到AD小鼠大脑的小胶质细胞活化和神经炎症性反应增高,通过诱导大脑奖励回路中的神经可塑性变化如pCREB、ΔFosB和脑源性神经营养因子(BDNF)蛋白水平升高,导致小鼠出现焦虑、抑郁行为。NLRP3炎症小体是焦虑和抑郁等精神障碍的重要靶点,AD小鼠海马体内NLRP3、caspase-1和IL-1β表达显著升高。
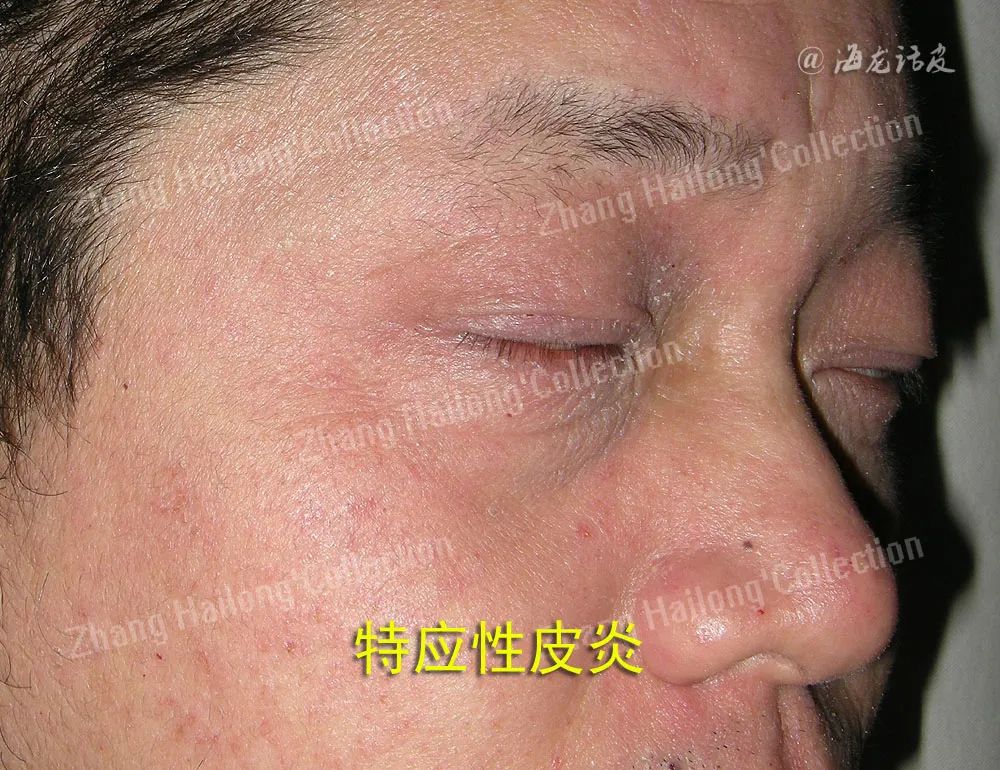
抗抑郁药氟西汀能改善DNCB小鼠AD样病变及抑郁/焦虑样行为,降低总IgE水平来抑制细胞因子如IL-4和IL-13mRNA的表达。还有研究认为中重度AD与焦虑和抑郁存在潜在反比关系,与AD中Th2型免疫反应偏移对疾病的保护作用有关。有研究发现精神状态和AD严重程度之间存在双向关系,AD严重程度与女性患者精神压力显著相关。
压力通过下丘脑-垂体-肾上腺轴(HPA axis)产生IL-4和TNF-α等炎症因子参与AD发病,还可产生P物质(SP)等神经递质诱导肥大细胞脱颗粒,释放组胺诱发瘙痒,出现瘙痒-搔抓-瘙痒恶性循环,加剧患者心理压力。改善患者心理压力能降低AD严重程度增加的风险,进一步防止疾病对心理健康产生负面影响。还有研究发现AD患者的认知功能会随着病情加重而逐渐下降,部分患者随着AD严重程度增加合并精神障碍和孤独症的概率逐渐升高。强迫症、精神分裂症、自杀倾向等精神疾病也与AD严重程度存在一定关联。
2.外源性因素
2.1微生物定植
研究表明金黄色葡萄球菌在AD患者皮肤上过度定植,导致皮肤的微生态失调和细菌多样性下降,产生超抗原激活T细胞诱导IL-4、IL-5、IL-13等细胞因子的生成和免疫炎症反应参与AD发病,其定植丰度增加与疾病严重程度呈正相关。与轻中度AD患者相比,重度AD金黄色葡萄球菌数量和总细菌载量更高。
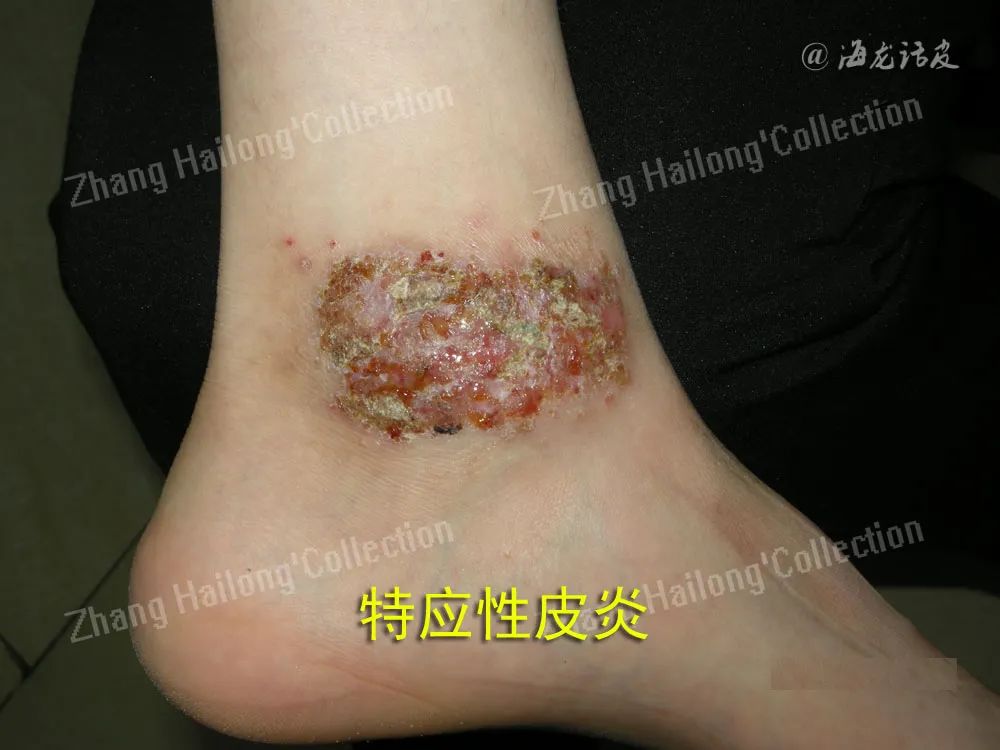
还有研究发现金黄色葡萄球菌定植伴随着表皮TEWL值和PH值的升高,通过产生毒素、蛋白酶和生物膜等毒力因子对皮肤屏障产生负面影响从而加重AD。表皮葡萄球菌在AD患者病变皮肤上丰度增加与严重程度呈负相关,通过激活角质形成细胞上Toll样受体2信号通路促进抗菌肽(AMPs)的表达,增强皮肤对金黄色葡萄球菌的免疫反应产生竞争抑制作用;在宿主-共生相互作用的机制中,表皮葡萄球菌产生特定细胞因子(如强效鞘磷脂酶Sph)产生保护性神经酰胺来维持皮肤屏障稳态。尽管表皮葡萄球菌对疾病有潜在的有益影响,但表皮葡萄球菌在AD皮肤上过度生长可导致非感染性破坏。近期研究认为表皮葡萄球菌可产生苯酚可溶性调节素肽(PSM)促进IL-17信号通路细胞因子及趋化因子上调诱导炎症反应导致疾病加重。表皮葡萄球菌与严重程度的关联性还需进一步研究。
马拉色菌是常驻皮肤的一种亲脂性酵母菌,马拉色菌特异性IgE是评估成人AD患者严重程度的重要过敏原特异性标志物。AD患者马拉色菌定植密度高于健康人群,对马拉色菌过敏的成人AD症状更重。在头颈部AD患者面部皮损处 限制性马拉色菌和球形马拉色菌定植数量与AD严重程度呈正相关。马拉色菌可通过诱导过敏、免疫及炎症反应的发生,分解皮肤屏障的脂质结构参与AD发病,但其诱导AD加重的机制还需进一步探究。
2.2 过敏原
2岁以内对食物过敏的中重度AD患儿病情更重且病程更长,AD发病年龄越早,病情越严重,食物致敏发生率越高。另外研究发现与没有食物过敏或仅对一种食物过敏的AD儿童相比,同时对多种食物敏感的患儿通常病情更严重。还有学者认为AD严重程度与食物过敏无相关性,过度依赖过敏原检测导致食物过敏假阳性率升高。
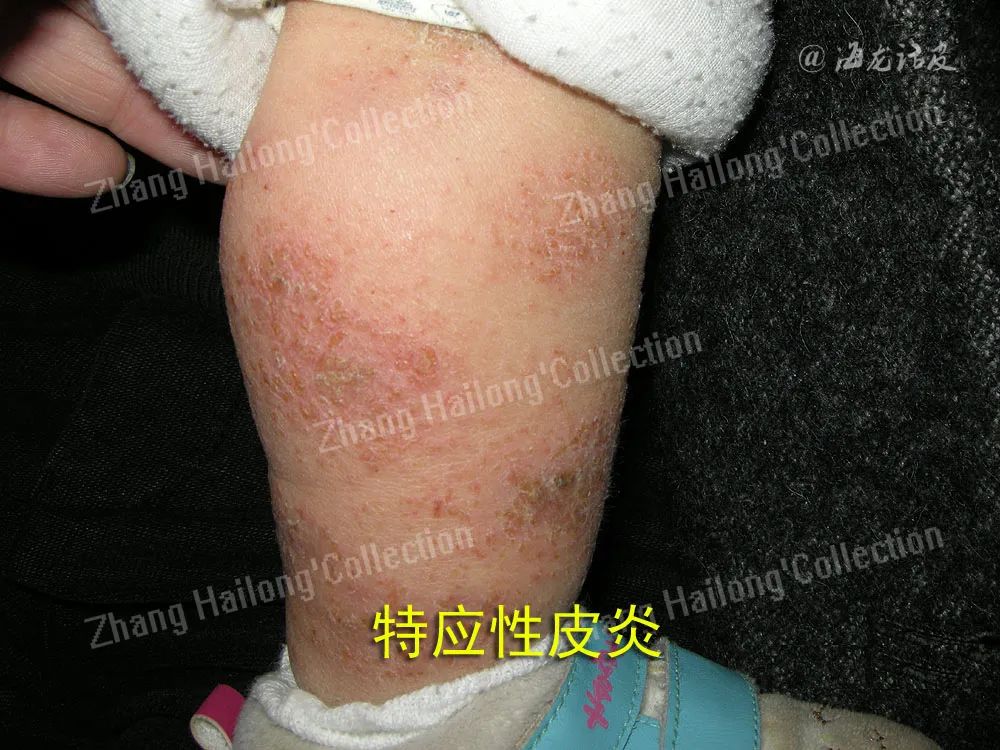
无论严重程度如何,尽可能明确AD患者食物过敏原种类,加强饮食管理,可避免AD患者过敏现象发生。尘螨是AD最常见的吸入性过敏原,室内屋尘螨(HDM)与室内细颗粒物(PM)2.5共同致敏会导致AD病情加重。在对HDM不致敏的AD患者中也观察到HDM水平与AD疾病严重程度有关。无论是否对机体致敏,HDM都可能是AD的一个加重因素。发生在局部的非典型AD易与变应性接触性皮炎(ACD)混淆。
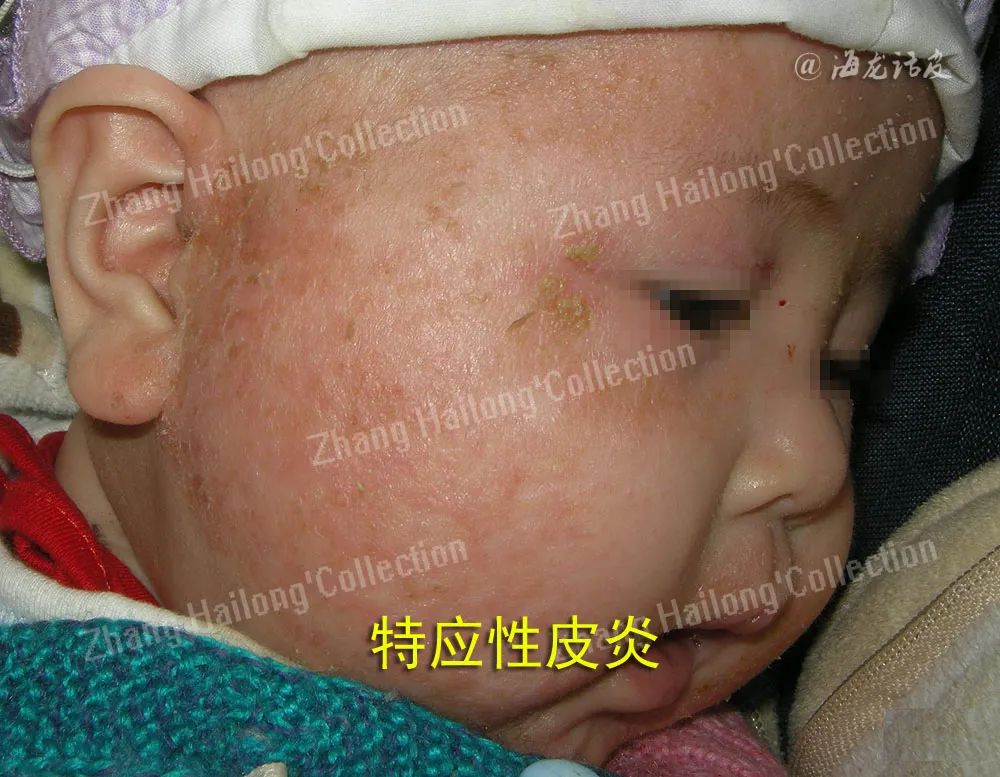
AD发病与遗传易感性和环境的共同作用有关,而ACD作为一种迟发型IV型超敏反应,更多取决于特定的接触过敏原和个人反应性。两者在临床表现、皮损分布及免疫机制上存在相似性。既往研究认为AD对ACD具有保护和协同作用,慢性AD反复发作可能合并接触致敏风险增加,SCORAD评分也与接触致敏风险呈正相关,金属(如镍、钴等)接触致敏阳性率在AD患者中明显升高,Mikajiri等对金属过敏的AD患者进行饮食干预,1月后随着Ni、Co等摄入量减少,患者皮损面积缩小,SCORAD评分降低,临床症状明显改善。还有一些研究认为轻中度AD合并接触致敏的风险升高,而重度患者风险降低,也有研究认为两者并无关联,彼此之间独立存在。
2.3吸烟
吸烟是AD的重要危险因素,吸烟者AD发病率更高。中重度AD患者被动吸烟概率明显高于轻度患者,被动吸烟的AD患者病情也更重。目前吸烟对AD作用机制不明,可能与遗传易感性、炎症反应和影响屏障功能相关。早期研究认为烟草里的气态和颗粒态化合物诱导细胞氧化应激,产生活性氧(H2O2)作用于角质形成细胞,参与调节皮肤脂质特性、降低游离脂肪酸活性从而影响表皮渗透屏障功能。另一方面烟雾促进TNF-α、IL-1、IL-6、 IL-8等炎症因子释放,诱导B细胞产生IgE,延迟产生的芳香烃受体也参与了AD发病。
2.4汗液
出汗对维持皮肤稳态和保持水分具有重要作用。AD患者汗腺紧密连接减少,汗液容易渗漏至真皮,汗液中的抗菌肽(如LL-37)、蛋白酶、外源性抗原(如17kDA抗原)等成分诱导或加重瘙痒。汗液中的葡萄糖与严重程度具有正相关性,其作用机制尚不明确,可能在发病早期汗液延缓皮肤屏障恢复从而导致病情加重。另一方面,汗液中天然保湿因子(NMF)如氨基酸、吡咯烷酮碳酸(PCA)等对皮肤屏障存在保护作用,AD患者皮损中NMF高于健康皮肤提示汗液参与保护AD渗透屏障,提高排汗能力AD患者症状反而得到改善,汗液在诱导AD加重或缓解中所发挥的作用需结合患者皮肤具体情况进行综合评估。
3.小结与展望
遗传因素、年龄、特应史、精神因素、微生物定植、过敏原、吸烟和出汗等多种危险因 素可能诱发或加重AD,指导患者正确识别和规避危险因素是AD患者长期个性化管理的重要环节,有助于减少复发并提高患者的临床疗效及生活质量。
参考文献:
1.王婷妤,华丕砚,姚秋艳,顾华.特应性皮炎危险因素与严重程度相关性的研究进展[J/OL].中国皮肤性病学杂志.https://doi.org/10.13735/j.cjdv.1001-7089.202405037.
2.张琦,禹卉千,李振鲁.接触性皮炎与特应性皮炎相关性的研究进展[J].中国皮肤性病学杂志,2019,33(7):840-844.
3.中华医学会皮肤性病学分会免疫学组特应性皮炎协作研究中心.中国特应性皮炎诊疗指南(2020版)[J]. 中华皮肤科杂志, 2020,53(2):81-88.
4.Egawa G,Kabashima K.Barrier dysfunction in the skin allergy[J].Allergol Int, 2018, 67(1):3-11.
5.其他参考文献(略).




