原发中枢神经系统淋巴瘤(PCNSL)现在称为免疫豁免部位淋巴瘤,其标准一线治疗依赖于以大剂量甲氨蝶呤(HD-MTX)为基础的诱导多药化疗,随后进行巩固治疗以降低复发风险。符合条件的反应患者可以从根据年龄调整的以塞替派为基础的自体干细胞移植(IC-ASCT)中获益。由于存在不可逆的严重神经毒性的风险,传统(36–40Gy)全脑放疗(WBRT)已不再推荐。对于不适合强化巩固治疗的患者,正在评估其他替代方案。尽管如此,仍有30%到50%的患者对HD-MTX耐药或在巩固治疗后复发。体弱和老年患者的预后仍然极差。
对PCNSL细胞的分子特征和PCNSL肿瘤微环境的表征突出了潜在的治疗靶点。Bruton酪氨酸激酶抑制剂(BTKi)、免疫调节剂(IMiDs)和检查点抑制剂在PCNSL中显示出临床活性。CAR-T也在复发或难治PCNSL中进行了评估,并取得了令人鼓舞的结果。现在,人们重新审视调节血脑屏障(BBB)的概念,针对脑部微血管的分子研究取得了令人鼓舞的结果。但这些治疗方式在治疗策略中的最佳位置仍有待确定。
《Current Opinion in Oncolog》近日发表综述,介绍了PCNSL治疗策略的最新进展。

一线治疗策略
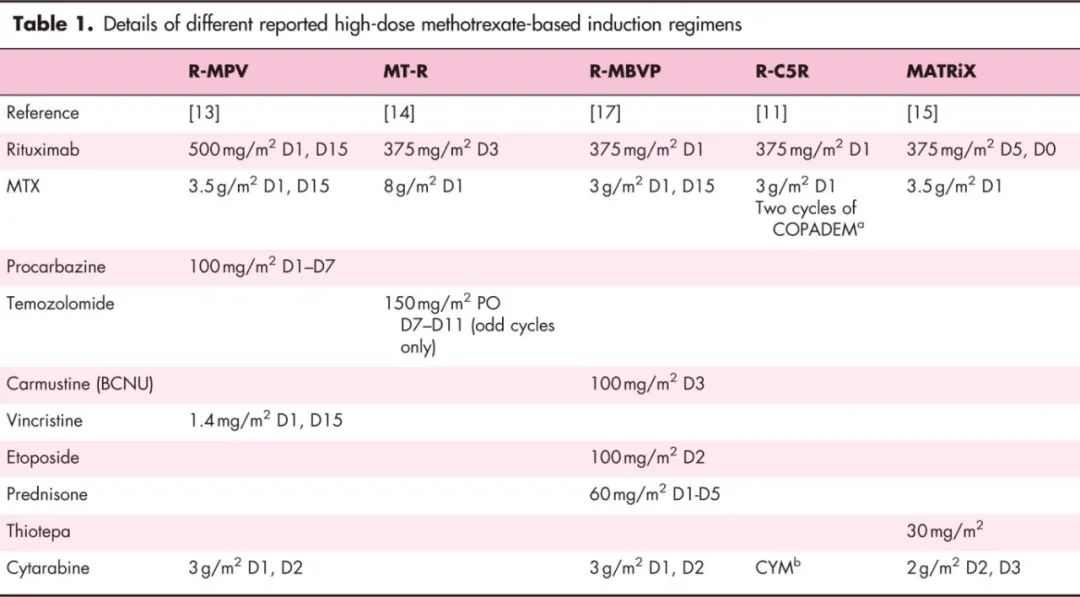
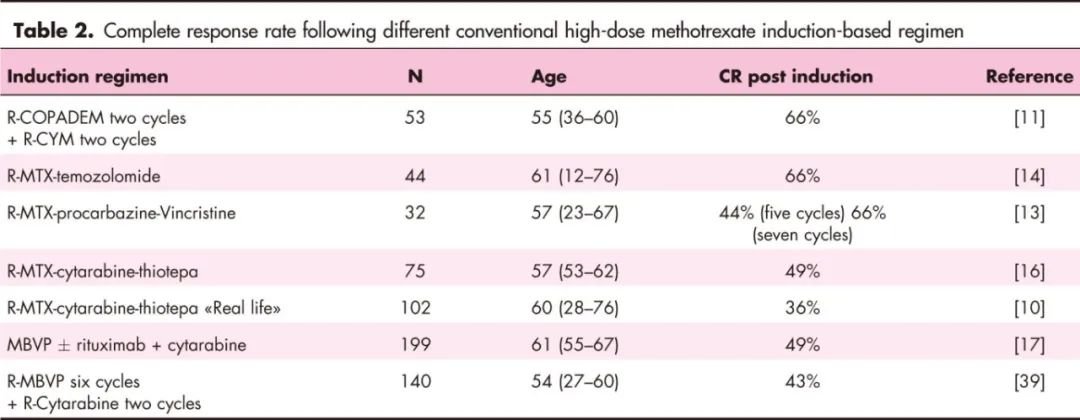
已有许多试验将大剂量甲氨蝶呤(HD-MTX)与各种药物联合使用(表1)。各研究中的总缓解率(ORR)和完全缓解率(CR)相似,表2所列的较大型研究中CR率也低于50%。毒性特征因方案而异,MATRIX和R-C5R方案的血液学毒性较高。目前尚无标准诱导方案。在最新的欧洲医学肿瘤学会-欧洲血液学会协会指南中,诱导方案的选择主要依据各医疗机构对不同方案的经验,以便更好地管理治疗相关毒性。
抗CD20抗体
两项国际前瞻性随机试验评估了在PCNSL诱导治疗中加入利妥昔单抗的效果,结果不一(表3)。
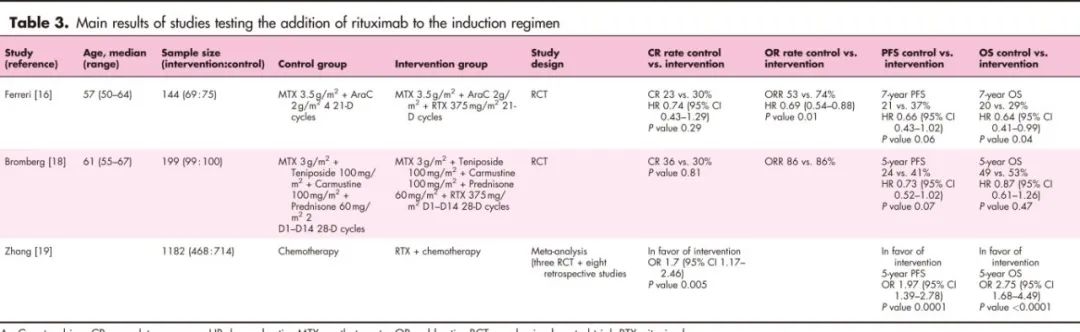
一项纳入1182名患者的荟萃分析表明,添加利妥昔单抗与更好的CR、无进展生存期(PFS)和总生存期(OS)相关。尽管利妥昔单抗在PCNSL中的作用仍有争议,但由于额外毒性较小,临床上仍广泛使用,由医生酌情使用。
靶向治疗
近期研究揭示了PCNSL的生物学特性。淋巴瘤细胞存在参与BCR、TLR和NF-KB信号通路的基因改变。脑部肿瘤微环境(TME)也具有特定特征,涉及T细胞、小胶质细胞、内皮细胞、趋化因子和细胞因子。Ig与自身蛋白结合的作用被视为潜在病理生理机制。在HD-MTX为基础的化疗中加入靶向治疗(如BTKi和IMiDs)得到PCNSL生物学的支持,并且伊布替尼和来那度胺在复发/难治性PCNSL中的良好结果也提供了依据。表4列出了在诱导方案中加入靶向治疗的结果。
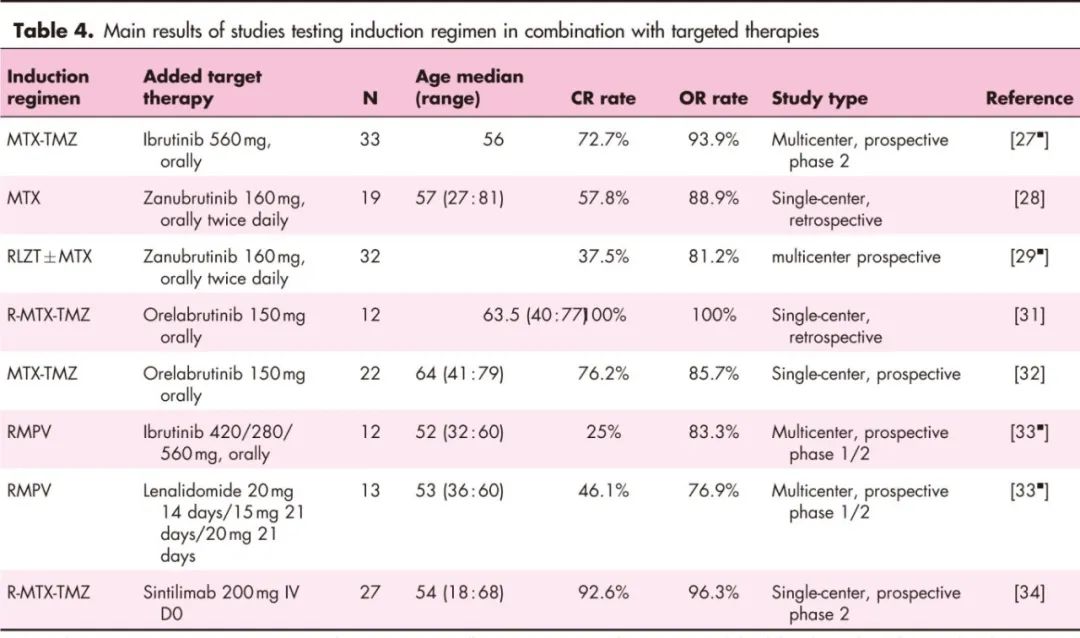
一项前瞻性2期研究在33名一线诱导治疗患者中联合使用HD-MTX、伊布替尼和替莫唑胺(MIT),ORR达93.9%,其中CR为72.9%,且无重大安全问题。
在加入二代BTKi泽布替尼的诱导方案的小型回顾性和前瞻性研究中,初步结果似乎并未显著提高CR率。
根据一项回顾性和一项单中心2期前瞻性研究,奥布替尼联合利妥昔单抗、甲氨蝶呤和替莫唑胺的CR率达到70-80%。
法国研究团队报告了随机LOC-R01研究的1b期结果,评估了在一线治疗中将伊布替尼或来那度胺加入到利妥昔单抗-HD-MTX-丙卡巴肼-长春新碱(R-MPV)中的效果。两种联合方案的安全性与R-MPV和靶向治疗一致。这些靶向诱导的获益将在研究的2期部分进行评估。
在一项2期前瞻性单中心试验中,抗PD1抗体信迪利单抗与利妥昔单抗-HD-MTX-替莫唑胺联合使用。27名患者中有25名达到CR,1名达到部分缓解(PR)。
巩固期/强化疗
在当前的诱导治疗下,巩固治疗对于降低复发率至关重要。由于治疗相关神经认知功能下降,标准剂量(36–40Gy)的WBRT已被弃用。
以塞替派为基础的自体干细胞移植(IC-ASCT)
近年来,一线治疗中越来越倾向于使用IC-ASCT,归于其在控制疾病和无治疗相关神经毒性方面的有效性。在真实世界经验(RWE)中,首次CR或PR后接受ASCT的患者5年总生存期(OS)和5年无进展生存期(PFS)分别为80%和74%。两项大型登记组、回顾性研究表明,与BEAM方案相比,以塞替派为基础的强化疗效果显著更好。
对于首次复发且之前未接受IC-ASCT的患者,应考虑使用IC-ASCT进行巩固治疗,因为后续复发时进行IC-ASCT的预后较差(5年PFS分别为48%和25%)。
非清髓性化疗和低剂量WBRT也在一线治疗中作为巩固治疗进行了评估。
一项随机2期试验比较了卡莫司汀-塞替派-ASCT与非清髓性化疗(依托泊苷-阿糖胞苷),结果支持ASCT组,2年PFS分别为73%和51%,但应注意,ASCT组诱导治疗后达到CR的患者更多。随机3期试验IELSG43比较了IC-ASCT策略(卡莫司汀-塞替派)与两疗程利妥昔单抗-地塞米松-依托泊苷-异环磷酰胺-卡铂(RDeVIC)。ASCT组的3年PFS和OS显著高于DeVic组(3年PFS分别为79%和59%;3年OS分别为86%和71%)。
随着老年患者身体状况的改善,IC-ASCT的年龄上限也逐渐提高。MARTA 2期研究表明,调整剂量的高强度化疗(利妥昔单抗-白消安-塞替派)联合ASCT可使65岁或以上的特定患者受益,44例患者中12个月PFS为58.8%。一项针对70岁以上患者的IC-ASCT与丙卡巴肼维持治疗的对比试验正在进行(NCT06830421)。
低剂量全脑放疗(ldWBRT)
一项随机研究表明,低剂量全脑放疗(ldWBRT,23.4Gy)的巩固治疗效果得以维持。共91名患者被随机分配到不巩固治疗组(中位年龄59岁)或ldWBRT组(中位年龄66岁)。中位随访55个月后,ldWBRT组的中位PFS未达到,而观察组为25个月。需要更长时间的随访和更成熟的数据来确认该放疗方式的安全性,特别是在60岁以上的患者中。ldWBRT已成为不适合ASCT患者的替代巩固治疗选项。
维持治疗
由于患者诊断时的中位年龄为67岁,40%的患者年龄在70岁以上,相当一部分患者不适合接受强化巩固治疗,导致中位PFS不到1年。多种药物可用作维持治疗(表5)。
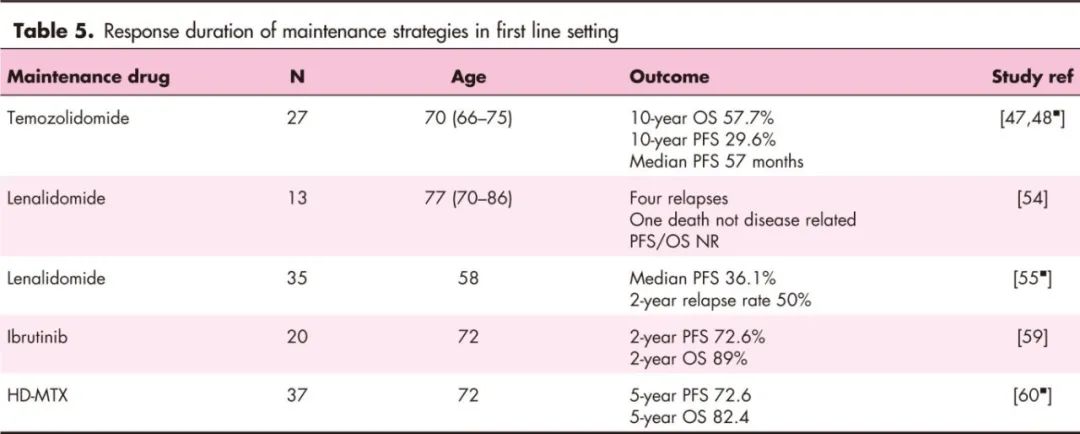
替莫唑胺
在北欧小组的2期研究中,15名年龄在65–75岁的患者接受了替莫唑胺(150mg/m2,第1–5天)维持治疗,持续长达1年。10年OS和PFS分别为29.6%和21.3%,中位PFS为57个月,而历史数据显示10年OS为9%。
来那度胺
来那度胺在三个CNS区域显示出临床疗效,理论上部分是通过其对TME的免疫调节作用。
来那度胺两项回顾性队列研究的结果存在矛盾。Vu等报告了一组13名70岁以上患者的回顾性系列研究,这些患者在对甲氨蝶呤/利妥昔单抗为基础的一线诱导治疗达到PR或CR后接受来那度胺维持治疗(5–10mg/天,中位持续时间18个月)。中位随访31.6个月后,中位PFS尚未达到。
北京协和医院一项回顾性研究报告了35名在HD-MTX诱导治疗后达到CR或PR的患者,患者中位年龄为60岁。维持治疗组接受口服来那度胺(25mg/天,21/28天)治疗,中位持续时间18个月。与无维持治疗的回顾性组相比,PFS无差异(分别为36.1个月和30.6个月;风险比0.78;95%置信区间),但来那度胺显著改善了诱导治疗后PR患者的PFS和OS。
在复发环境中,来那度胺维持治疗(10mg/天)在前瞻性REVRI研究中表现令人失望。只有5名患者完成了1年的维持治疗。11名患者在维持治疗期间疾病进展,2名患者死于治疗相关毒性。
一项针对70岁以上患者的一线维持治疗试验正在进行,使用来那度胺或替莫唑胺(NCT03495960)。
伊布替尼
伊布替尼对免疫TME有off-target效应,通过减少髓系来源的抑制细胞和增强Th1免疫反应。
一项2期前瞻性研究评估了伊布替尼维持治疗在20名患者(中位年龄72岁;范围61–80岁)中的一线治疗效果。2年PFS和OS分别为72.6%和89%,其中5例为淋巴瘤相关死亡。这些结果与真实世界经验中位OS为15个月相比更为乐观。
大剂量甲氨蝶呤
一项单中心回顾性研究报告称,HD-MTX维持治疗(8 g/m²,中位11个周期)与塞替派-卡莫司汀ASCT后的OS和PFS相似。一项3期随机研究(NCT02313389)的结果尚待公布,该研究针对60岁以上患者在RMPV治疗后达到CR的情况下,分别接受无维持治疗或R-MT维持治疗。
丙卡巴肼
PRIMAIN研究报道了在107名65岁以上患者中,初始诱导治疗使用R-MPV后,接受6个月丙卡巴肼维持治疗的2年OS为47%。
新兴治疗路径
Bruton酪氨酸激酶抑制剂通路抑制
另一种BTK抑制策略是开发BTK降解剂,在B细胞肿瘤中初步结果令人鼓舞。BTK降解剂目前正在PCNSL和继发性CNSL中进行评估 [(NCT05006716); (NCT04830137, NCT05131022); (NCT04861779)]。
白细胞介素-1受体相关激酶4抑制剂
白细胞介素-1受体相关激酶4(IRAK4)被招募到Toll样受体信号通路,激活NF-κB信号通路,由MYD88适配蛋白促进。在12名R/R PCNSL患者中使用新型IRAK4抑制剂Emavusertinib联合伊布替尼治疗的初步结果中,ORR为50%,包括3例CR。
检查点抑制剂
PD-1/PD-L1通路在PCNSL中可能被改变。在47名R/R PCNSL患者中进行的纳武利尤单抗单药治疗的前瞻性2期试验的初步结果显示,DOR为1.7个月,OS为6.8个月(NCT02857426)。在41名R/R PCNSL患者中进行的帕博利珠单抗单药治疗的前瞻性2期研究中,ORR为29%,中位DOR为10个月。几项正在进行的前瞻性研究正在评估抗PD-1单药或联合靶向药物在治疗的诱导或维持阶段的效果(NCT04609046, NCT04401774, NCT05425654, NCT04022980)。
双特异性抗体
CD20/CD3双特异性抗体Epcoritamab和格菲妥单抗已获批准用于不适合或CAR-T细胞治疗失败的R/R系统性弥漫大B细胞淋巴瘤(DLBCL)。在中枢神经系统淋巴瘤中的数据非常有限。
据报道,4名继发性中枢神经系统淋巴瘤患者接受了格菲妥单抗治疗。由于三名患者同时接受了其他抗淋巴瘤治疗,临床疗效难以确定。然而,对脑脊液(CSF)中淋巴样细胞群的分析显示,格菲妥单抗能够将T细胞重定向到CSF中,体外实验也证明了格菲妥单抗在CSF中的有效浓度。没有患者出现ICANS。一项前瞻性研究将专门评估Epcoritamab与利妥昔单抗和来那度胺联合用于难治性/复发性PCNSL的疗效和毒性(NCT06931652)。
优化靶向治疗的使用
多组学方法根据淋巴瘤细胞的突变特征和TME的免疫状态,将PCNSL分为四个亚组,这些亚组具有不同的临床结果。在临床研究中,需要替代标志物来识别这些亚组。它们确实允许在具有适当突变特征和TME免疫状态的患者亚组中测试上述靶向药物。
CAR-T细胞治疗
由于担心神经毒性风险增加,CNS淋巴瘤被排除在CD19 CAR-T细胞治疗DLBCL的关键试验之外。
CAR-T细胞治疗在复发或难治性继发性和原发性CNS淋巴瘤中显示出有希望的疗效,最初是在小病例系列或早期前瞻性研究中,后来在更大的患者队列中。各研究中报告的CAR-T细胞治疗后的缓解率一致,范围为60%至95%。1年PFS从15%至25%不等,甚至40%,晚复发病例很少。
鉴于复发时疾病的侵袭性,CAR-T细胞治疗前使用桥接治疗的频率很高。桥接治疗高度多样化,取决于之前的治疗线数和患者特征。作为桥接治疗的CNS放疗并未显示出增加ICANS的信号。几项研究报告称(包括国内一项多中心研究使用瑞基奥仑赛注射液治疗的22例患者),CAR-T细胞输注前反应良好的患者预后显著更好。ICANS的风险为36%至68%,其中≥3级ICANS为5%至29%。
在几个队列中报告了假性进展病例,也称为肿瘤炎症相关神经毒性。与系统性DLBCL不同,在经历3级或4级ICANS的PCNSL患者中,可以观察到长期的神经功能恶化(中位100天)。其他毒性,尤其是CRS的发生率和等级,在CNS和系统性淋巴瘤中似乎相似。
CAR-T细胞治疗是PCNSL的一种有希望的治疗方法,尽管其在疾病管理中的确切位置仍有待确定。
其他给药形式
PCNSL的一个特点是BBB,其解剖和功能特性阻碍了治疗药物进入脑实质的输送。虽然肿瘤周围BBB可能受损,但在其他脑区BBB仍保持完整,而这些区域可能观察到弥漫性浸润。
为了克服BBB并改善药物渗透,最初的策略依赖于通过颈内动脉注射甘露醇随后注射甲氨蝶呤来渗透BBB,这是一项需要在神经外科环境中反复麻醉的复杂技术。最近,通过使用靶向CD13+肿瘤血管的NGR-hTNF(一种与NGR结合的TNF-alpha肽),在BBB上取得了类似的效果,NGR-TNF与R-CHOP联合应用的初步临床结果令人鼓舞。
纳米技术策略是改善药物输送至大脑的一个活跃研究领域。纳米粒子是1至100纳米的亚显微颗粒,越来越多地用作药物输送载体和神经影像学工具。在临床前模型中,已测试其输送多柔比星的能力。
生物标志物
目前仍缺乏可靠的预后评分系统。需要生物标志物来更好地进行诊断时的风险分层,并作为治疗期间的动态预后因素。目前已确定的候选生物标志物包括脑脊液中的白细胞介素10、肿瘤中的CCL19,以及脑脊液/血浆中的循环肿瘤DNA(ctDNA)。
总结
在过去的10年中,巩固治疗策略发生了变化,主要是通过在符合条件的患者中普及IC-ASCT,同时传统WBRT的使用减少。在诱导治疗阶段几乎没有改进,目前正在评估在传统HD-MTX方案中添加靶向治疗的作用。对于不适合ASCT的患者,维持治疗的结果尚待确定。CAR-T细胞治疗是PCNSL治疗中一个有前景的工具。可靠的生物标志物以及识别PCNSL不同分子亚型的替代标志物将有助于评估个性化治疗和根据治疗反应驱动的策略。
参考文献
Gilbert, Adrien; Houillier, Caroline; Soussain, Carole. New treatment strategies for primary central nervous system lymphoma. Current Opinion in Oncology 37(5):p 414-423, September 2025. | DOI: 10.1097/CCO.0000000000001165




