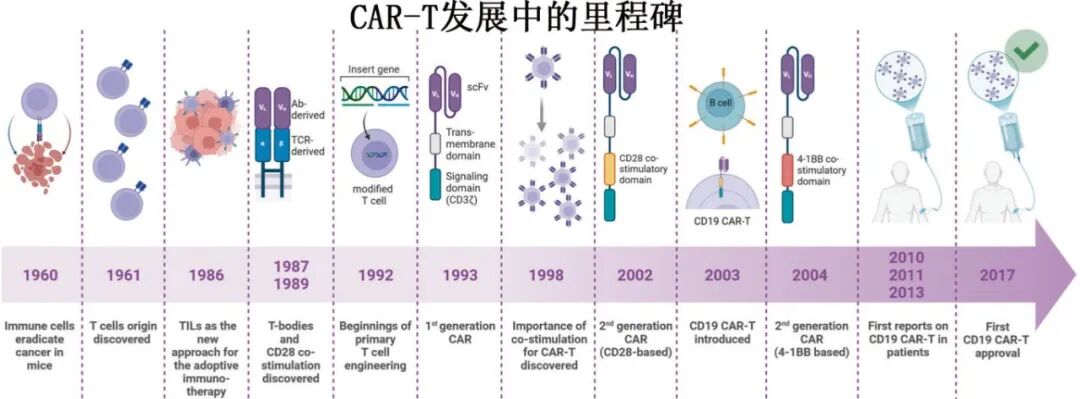
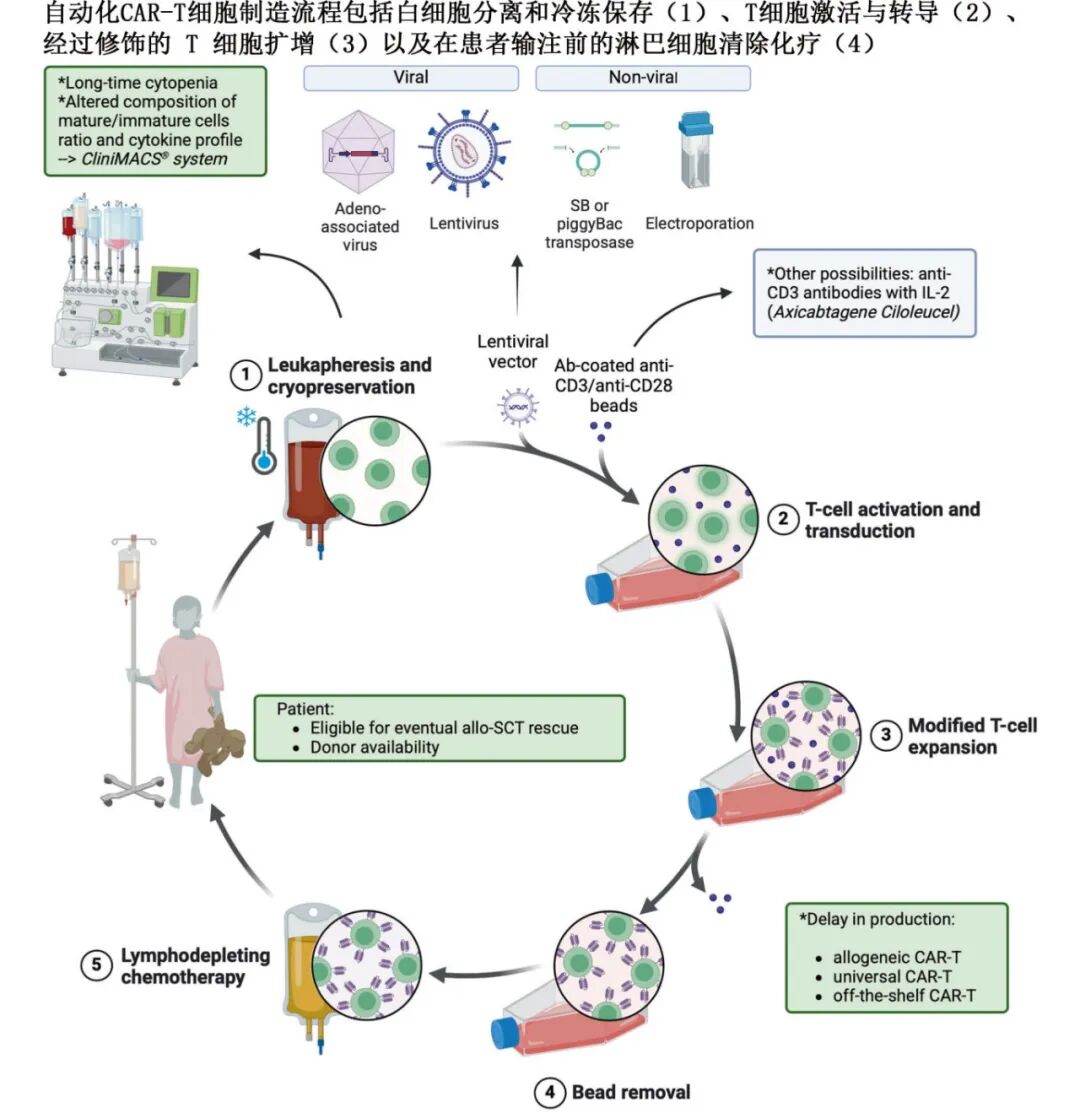
CAR-T细胞疗法是一种创新的免疫治疗方法,通过基因工程改造患者自身的T细胞,使其表达嵌合抗原受体(CAR),从而特异性地识别并攻击癌细胞。现代的 CAR-T 细胞疗法是数十年来免疫学和基因工程领域开创性研究的结晶。
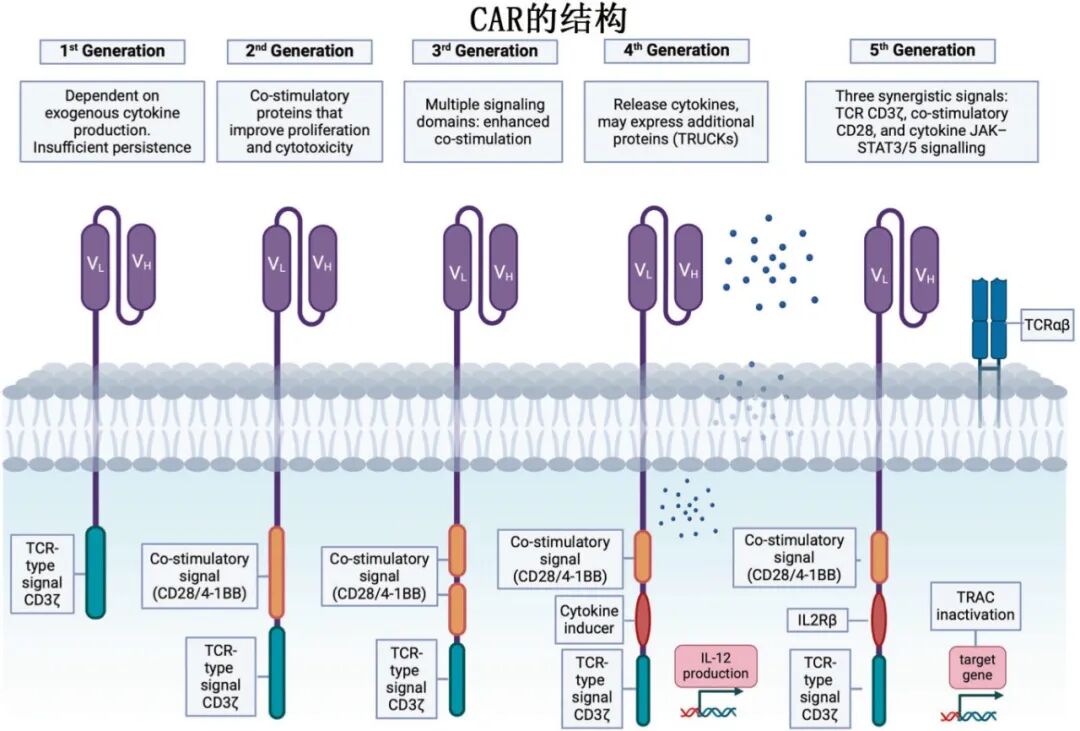
CAR结构包括CAR(嵌合抗原受体)由胞外抗原识别区(scFv)、铰链区、跨膜区和胞内信号区(如CD3ζ,共刺激域CD28/4-1BB等)组成,已经历了五代发展:第1代仅含CD3ζ信号,活性有限;第2代加入CD28或4-1BB共刺激域,显著增强持久性与疗效(目前所有获批产品均为第2代)。第3代整合多个共刺激域;第4代(TRUCKs)可分泌细胞因子,改造肿瘤微环境;第5代整合IL-2R等信号,增强记忆T细胞形成及系统免疫激活。
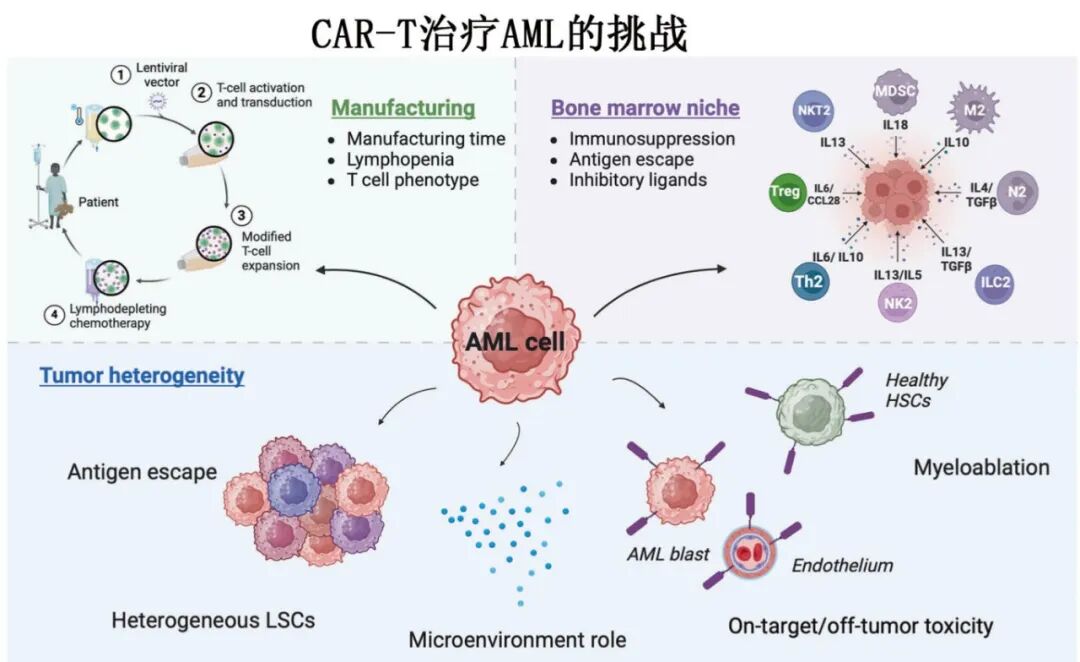
CAR-T治疗AML的挑战
CAR-T细胞疗法在治疗复发/难治性B细胞恶性肿瘤和多发性骨髓瘤方面取得了显著的临床成功,但尚未在急性髓系白血病(AML)中获得批准,原因在于存在的较大挑战:i)疾病的克隆异质性;ii)高度免疫抑制的骨髓(BM)微环境;iii)缺乏肿瘤特异性靶抗原。
AML的高度异质性
-
AML在分子、细胞遗传学和表观遗传学上具有高度异质性,存在多种亚型(如ELN 2022分类中的14个组别)。
-
白血病干细胞(LSCs)的存在和克隆演化导致疾病复发和治疗难治。
-
不同基因突变(如FLT3、NPM1、TP53、IDH1/2等)影响疾病行为和药物敏感性。
免疫抑制性骨髓微环境
AML微环境中存在多种免疫抑制机制:
-
代谢产物:乳酸、腺苷、犬尿氨酸等抑制T细胞功能。
-
免疫细胞:调节性T细胞(Tregs)、髓源性抑制细胞(MDSCs)、M2型巨噬细胞等。
-
免疫检查点:PD-1、TIM-3、LAG-3等高表达,导致T细胞耗竭。
-
血管重塑与缺氧:影响T细胞迁移和功能。
缺乏理想的靶抗原
理想靶点应满足:
-
高表达于AML原始细胞和LSCs;
-
不在正常造血干细胞(HSCs)或重要组织表达;
-
避免“on-target/off-tumor”毒性。
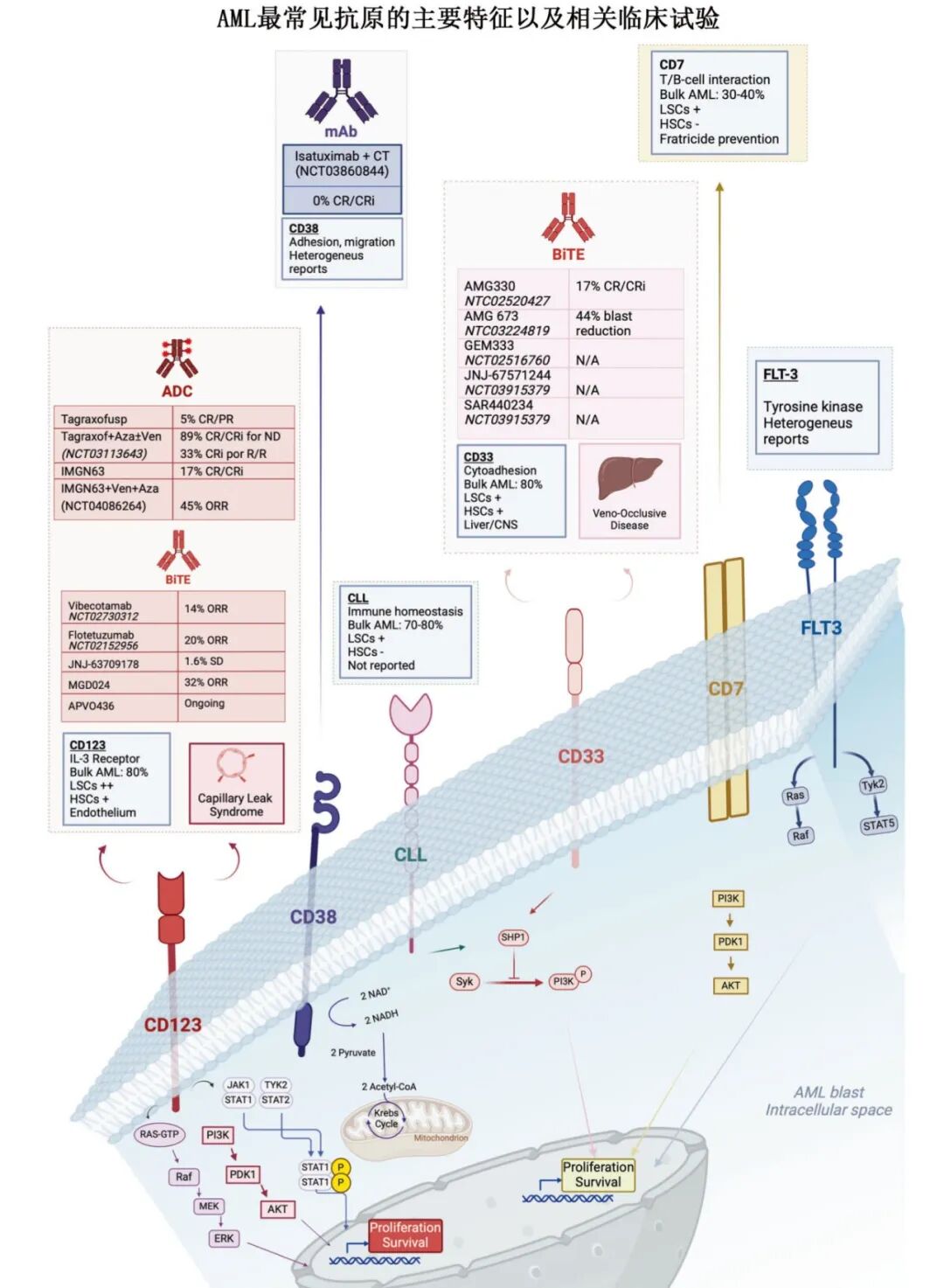
目前尚无完美靶点,常见靶点包括:
-
CD123(IL-3Rα):高表达于AML,但存在内皮毒性和骨髓抑制风险。
-
CD33:广泛表达,但可能与肝窦阻塞综合征相关。
-
CLI-1(CLEC12A):表达限于髓系,安全性较好。
-
其他:NKG2D、CD7、CD38、CD44v6、CD70、FLT3等。
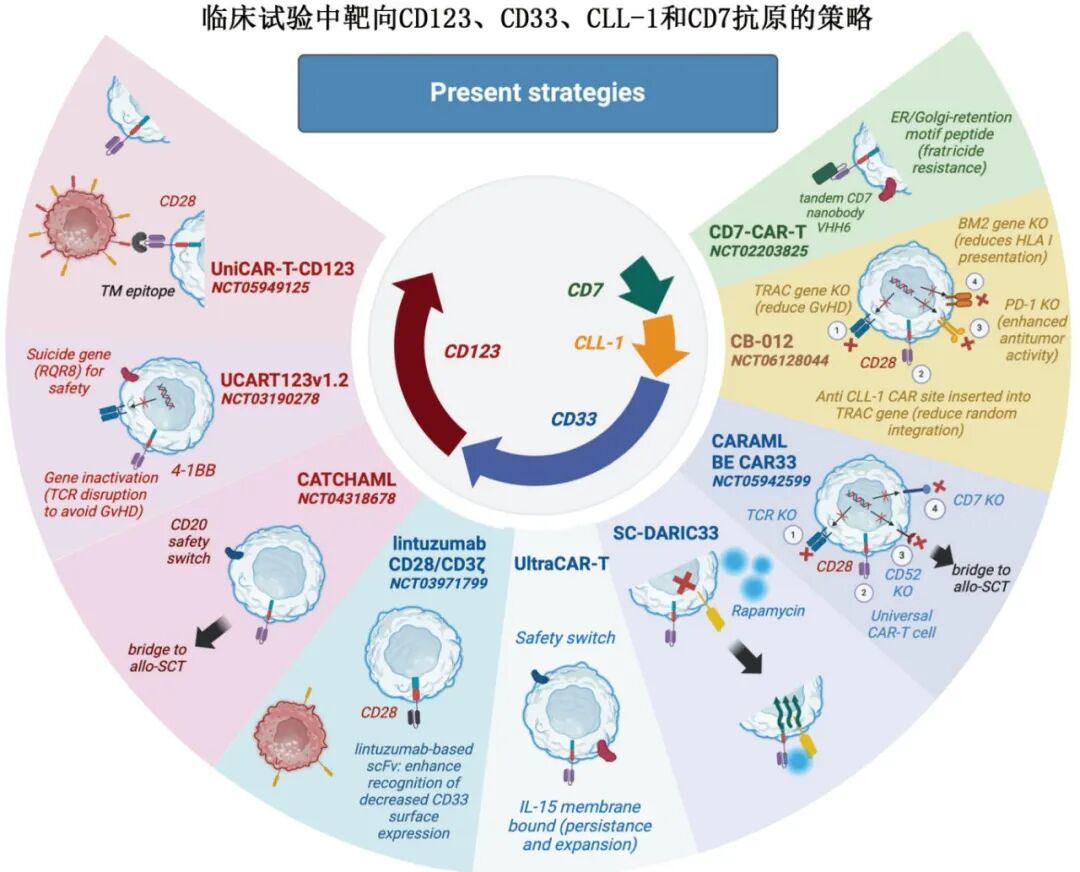
当前临床研究进展
-
CD123-CAR-T
-
UniCAR-T-CD123(德国):可快速开关的CAR-T系统,初步结果显示53%的客观缓解率(ORR),安全性可控。
-
UCART123(美国):通用型CAR-T,因严重CRS和肺毛细血管渗漏综合征一度暂停,后调整方案后重启。
-
CATCHAML试验:用于儿童R/R AML,作为移植前的桥接治疗。
2. CD33-CAR-T
-
CD33CART(NCT03971799):在儿童和年轻成人中显示良好反应,部分患者达到完全缓解。
-
PRGN-3006(UltraCAR-T):非病毒Sleeping Beauty(睡美人)系统,含膜结合IL-15,增强体内扩增。
-
BE-CAR33:基于基因编辑的通用型CAR-T,避免GvHD和排斥。
3. CLI-1-CAR-T
-
在R/R AML中显示出良好安全性和初步疗效。
-
CB-012平台:使用Cas12a基因编辑技术,增强抗肿瘤活性。
4. 其他靶点
-
CD38:在移植后复发患者中显示出66.7%的ORR。
-
CD7:需克服T细胞自相残杀问题,已有成功临床案例。
-
NKG2D:因缺乏共刺激域和配体异质性,疗效有限。
未来发展方向
-
制造工艺优化
-
使用通用型CAR-T(UCART) 或供体来源CAR-T,缩短制备时间。
-
优化清淋方案,联合去甲基化药物(如阿扎胞苷)增强抗原表达。
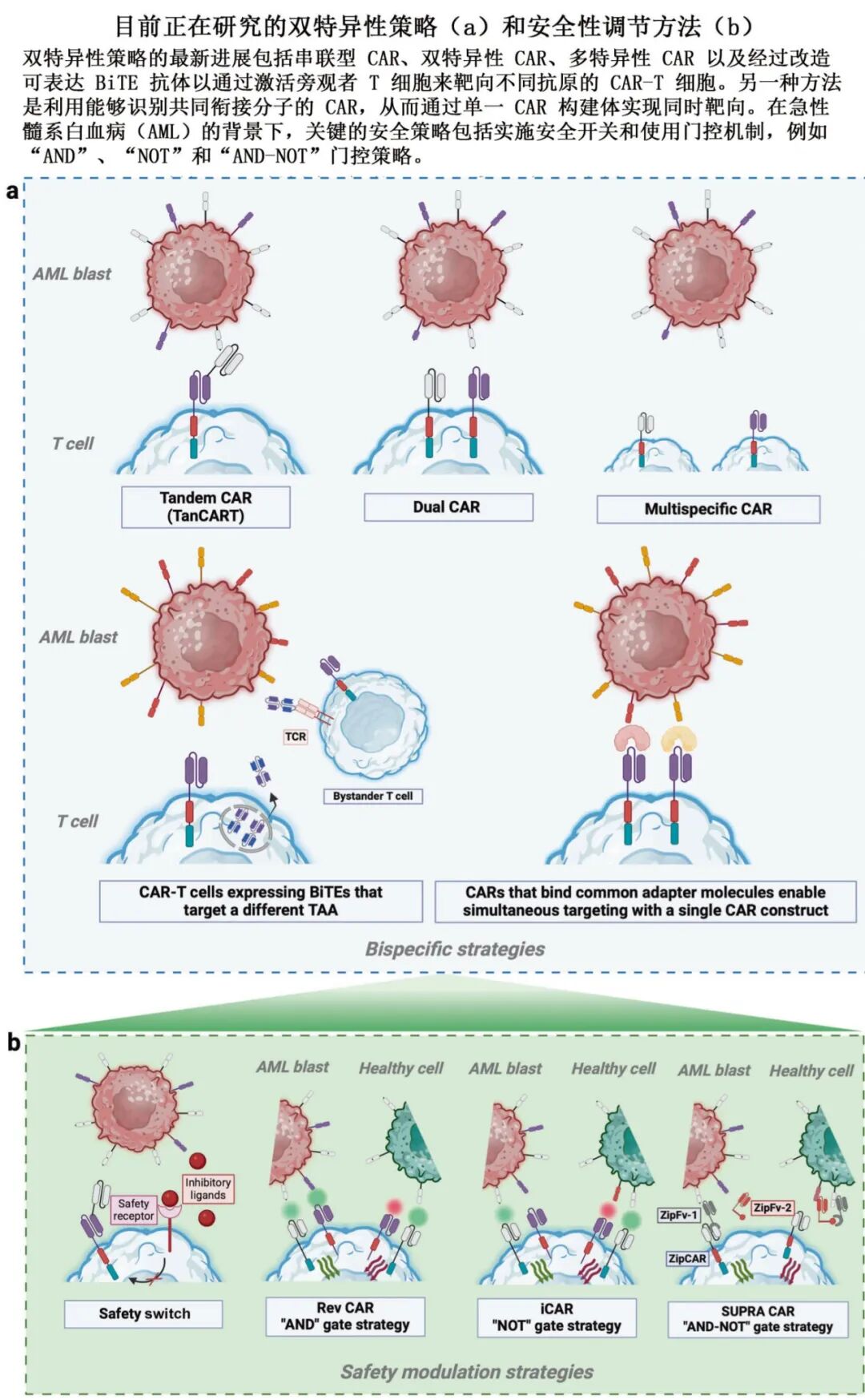
2. 应对抗原异质性
-
双靶点CAR-T(如CD123/CD33、CLI1/CD33)或串联CAR。
-
逻辑门控CAR(如“AND”、“OR”、“NOT”门)提高特异性。
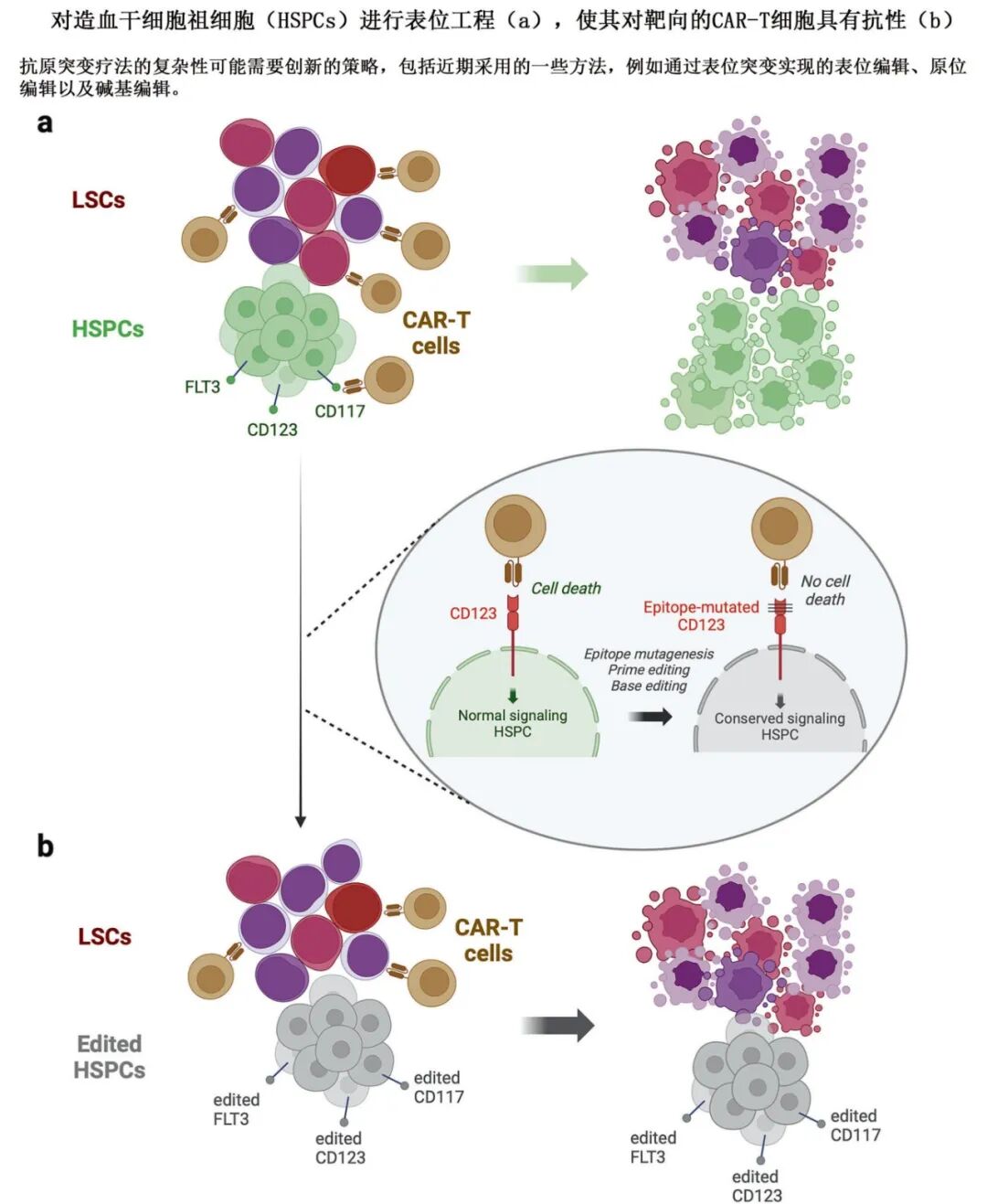
-
表位编辑:通过CRISPR编辑HSCs,使其对CAR-T不敏感,减少骨髓毒性。
3. 新型抗原开发
-
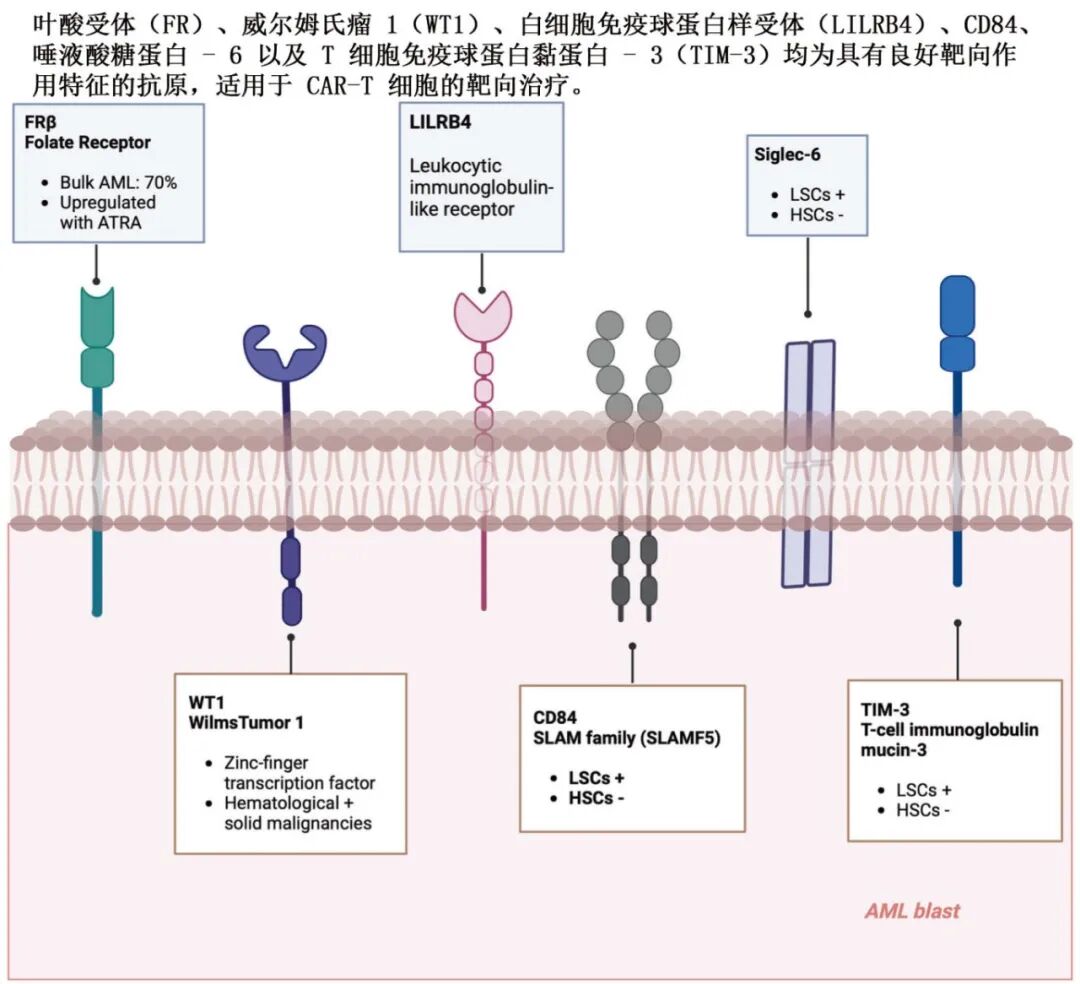
FRβ(叶酸受体β)、WT1、LLLRB4、CD84、Siglec-6、TIM-3等。
-
结构表面组学:识别AML特异性蛋白构象,如整合素β2。
4. 联合策略与微环境调控
-
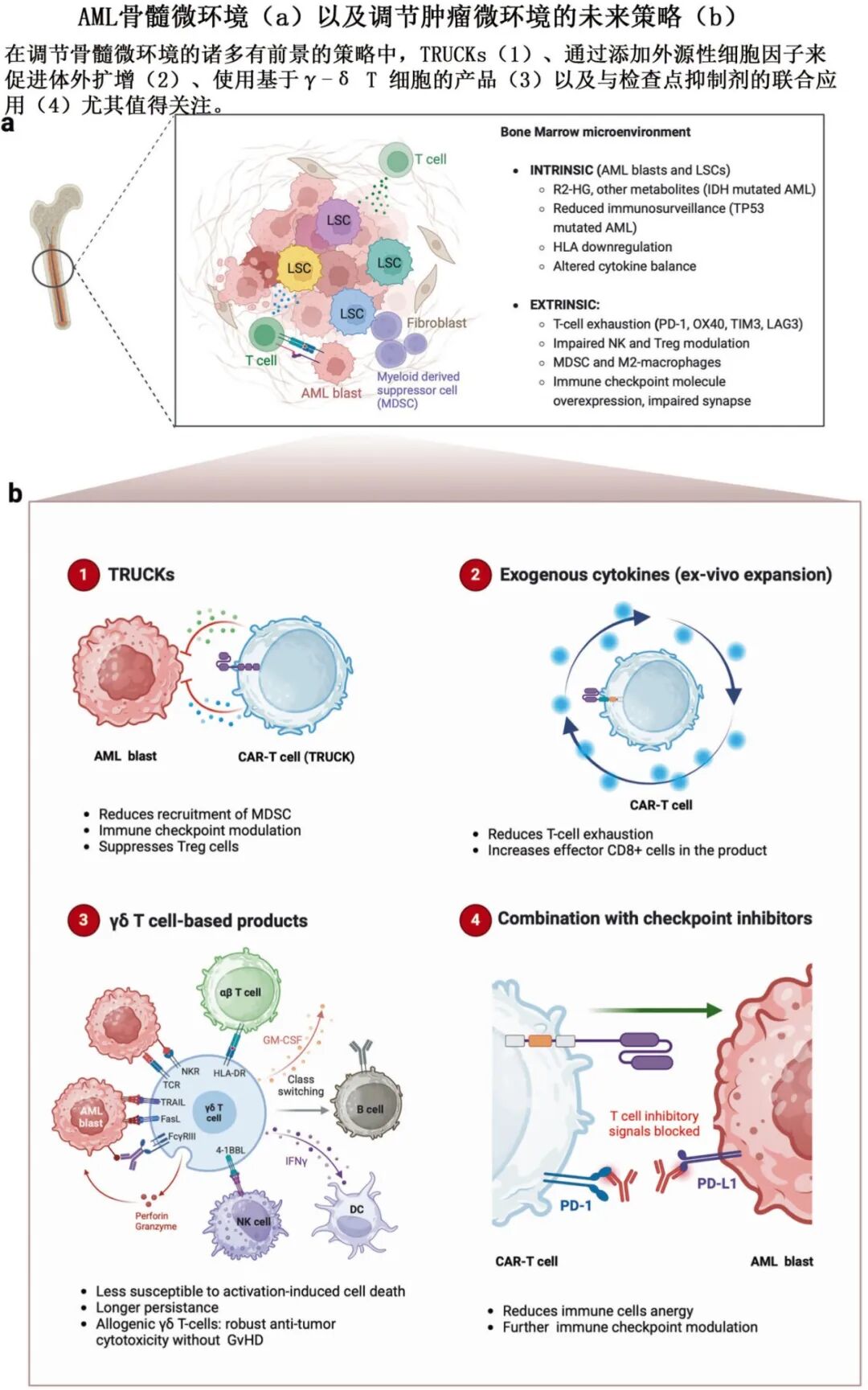
联合免疫检查点抑制剂(如抗PD-1、抗TIM-3)。
-
代谢调节剂(如PRODH2、IDO1抑制剂)增强CAR-T功能。
-
细胞因子工程(如IL-15、IL-18)增强CAR-T持久性。
-
γδ T细胞:具有抗肿瘤活性且不易引起GvHD。
5. 新型平台技术
-
STAb(分泌型T细胞接合抗体):CAR-T分泌双特异性抗体,激活旁观者T细胞。
-
TRUCKs:CAR-T携带细胞因子基因,改善微环境。
-
表观遗传调控:使用地西他滨等药物增强CAR-T功能和持久性。
总结
CAR-T细胞疗法在AML治疗中具有潜力,但仍面临诸多挑战。未来的研究方向包括优化靶点选择、提高CAR-T细胞的制造效率、增强其在体内的持久性和功能、以及开发新的联合疗法以克服AML的异质性和免疫抑制微环境。通过这些努力,CAR-T细胞疗法有望在AML治疗中发挥更大的作用。
参考文献
Zugasti, I., Espinosa-Aroca, L., Fidyt, K. et al. CAR-T cell therapy for cancer: current challenges and future directions. Sig Transduct Target Ther 10, 210 (2025). https://doi.org/10.1038/s41392-025-02269-w




